【高中化学】测定H2O2滴定FeCl2溶液的氧化还原滴定曲线——氧化还原电势传感器
今日实验:利用氧化还原电势传感器,测定H2O2滴定FeCl2溶液的氧化还原滴定曲线。

氧化还原电势 (ORP) 传感器测量一个溶液充当氧化试剂或还原试剂的能力。ORP代表氧化还原电势。例如,ORP电极经常被用于测量游泳池内氯气的氧化能力,或用做测定氧化还原反应的等当点。
威尼尔 ORP传感器能够测量在–450 至 +1100 毫伏范围内的氧化还原电势。此范围内催向正数区域的读数表明一个强氧化试剂,反之接近范围内负数区域的读数表明一个强还原试剂。
一.实验材料
实验仪器:电脑1台(Logger Pro软件),数据采集器(LabQuest-2或LabQuest mini ) 1台,氧化还原传感器(ORP-BTA)1支,滴数传感器(VDC-BTD)1支。
实验辅材:百岁山饮用水一瓶,0.5mol/L的FeCl2溶液50ml,0.5mol/L和0.25mol/L的H2O2溶液各50ml。


二.实验步骤
1. 连接好实验装置:氧化还原传感器和滴数传感器连接采集器,采集器连接电脑。
2. 实验用水(百岁山饮用水),测量溶剂的空白实验电势。
3. 分别测量0.5mol/LFeCl2溶液,0.5mol/L的H2O2溶液的电势。
4. 测量0.25mol/L的H2O2溶液滴定浓度约为0.5mol/L 50mL FeCl2溶液的氧化还原曲线图,将模式改为“数字事件”,点击采集按钮。
5. 整理好实验桌,数据分析处理。
三.实验分析
(1)溶剂用水空白实验
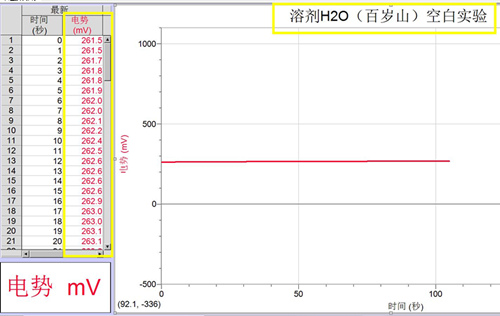
(图1)
(2)0.5mol/LFeCl2溶液的电势
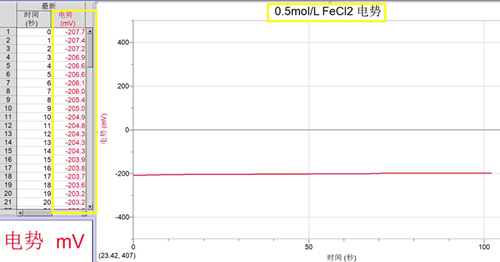
(图2)
(3)0.5mol/L的H2O2溶液的电势
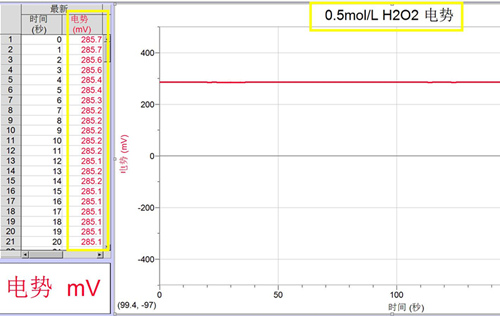
(图3)
(4)0.25mol/L的H2O2溶液滴定浓度约为0.5mol/L 50mL FeCl2溶液的氧化还原曲线
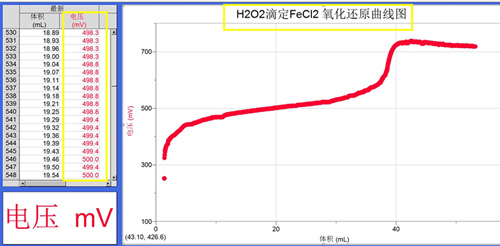
(图4)
数据分析:
1. 由图1、图2和图3可知,空白溶剂水(百岁山)约为+262mV,0.5mol/LFeCl2 酸性溶液的电势约为-200.0mV左右,0.5mol/LH2O2溶液的电势约为+285mV,实验数据定量证明亚铁离子具有较强的还原性,过氧化氢具有一定的氧化性。说明溶剂水的来源不同,对溶液的电势有一定的影响。
2. 图4氧化还原滴定曲线,当氧化剂H2O2滴入还原剂FeCl2溶液时,被滴定溶液中就生成了Fe3+,溶液的电压突变增大到300毫伏以上。此时溶液中是Fe3+/Fe2+共存体系,随着H2O2的加入,溶液中c(Fe3+)/c(Fe2+) 比值在增大,溶液的电势在逐渐增大(如图)。当Fe2+全部被氧化,达到滴定终点,溶液只有Fe3+时,电势又会突变,即滴定的等当量点,从而确定原FeCl2溶液的浓度。