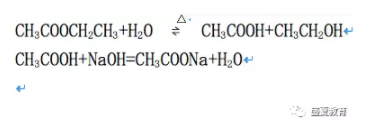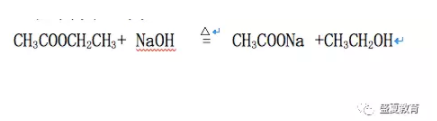【高中化学】用数字化实验探究乙酸乙酯的水解过程
人教版高中化学选修5《有机化学基础》第三章第三节中乙酸乙酯作为酯类水解的演示实验,教材通常根据乙酸乙酯的芳香气味浓淡来判断酯的水解程度,但这种闻气味的方法对水解程度的判断效果并不理想。本文采用威尼尔数字化实验监测水解过程中碱液的pH变化,根据曲线,我们不仅可以明显“看到”水解的进行情况,还能分析得到乙酸乙酯水解反应的实质。


1 实验原理
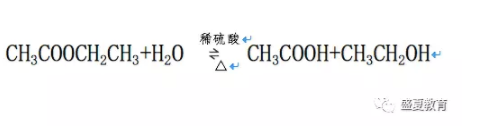
乙酸乙酯可以发生水解反应,生成乙酸和乙醇。常温下乙酸乙酯的水解程度较小,酸和碱可以加速水解反应的进行,在酸存在的条件下,乙酸乙酯水解是可逆反应;在碱存在的条件下,水解反应是不可逆的,这是由于水解产物乙酸与氢氧化钠作用生成乙酸钠,使反应进行到底。化学反应方程式为:
2 实验流程
【实验仪器和药品】
实验试剂:0.1mol/L氢氧化钠溶液、乙酸乙酯。
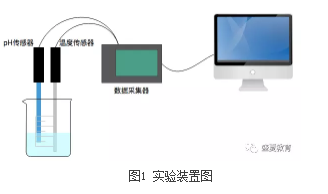
实验仪器:pH传感器、不锈钢温度传感器、数据采集器、计算机、Logger pro软件、烧杯、酒精灯、铁架台、量筒。
【实验步骤】
1. 向烧杯中加入30mL 0.1mol/L氢氧化钠溶液,放在酒精灯上加热至约40°C左右(可以用不锈钢温度传感器测量)。
2. 将pH传感器插入碱液中。
3. 点击数据采集按钮,开始采集数据,待示数稳定后,向烧杯中迅速加入5mL左右的乙酸乙酯。
4. 当溶液中的pH保持不变时,停止数据采集,得到pH随时间的变化曲线。
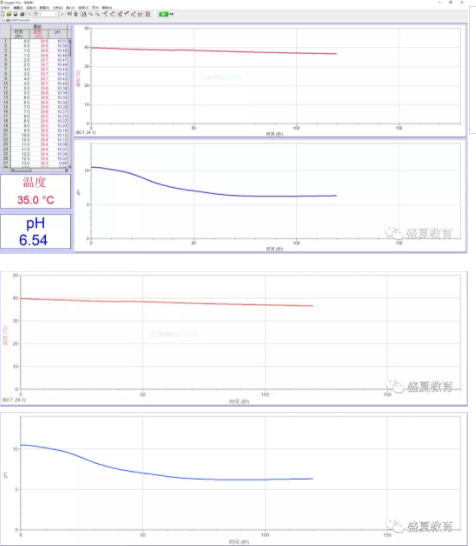
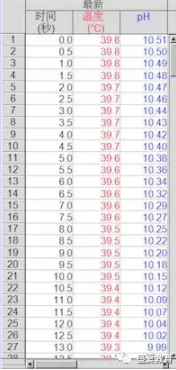
3 结果与分析
由于实验是在烧杯中进行的,通过观察宏观实验现象,我们可以发现,脂层并没有明显的减少。
总化学方程式为:
实验结束,曲线的表征让实验现象清晰呈现!
[1] 马宏佳. 化学数字化实验的理论与实践[M]. 人民教育出版社,2016。
注意:
在实验过程中,pH传感器的外壳一定不要直接接触含有乙酸乙酯药品的溶液中!否则会对传感器外壳造成不可逆性的伤害!
原因:
pH传感器外壳的材料为聚碳酸酯,根据传感器使用说明书——pH传感器不可放在高氯酸盐 (或酯)、银或硫离子的溶液中。
如果把pH传感器浸泡在乙酸乙酯溶液中,就会出现以下情况(小编在做实验之前,只是按照书中的步骤来操作实验,忽略了仔细查看说明书,结果发生了意外。):
pH传感器的外壳(聚碳酸酯)与乙酸乙酯发生反应,外壳开裂!
解决办法:
可以用塑料透明胶布将整个传感器的外壳、前端包裹住,露出玻璃探头即可。
透明胶布的材质一般是BOPP(双向拉伸聚丙烯薄膜)、PE(高密度聚乙烯)、PVC(聚氯乙烯)这三种材质。








但通过观察pH曲线,我们发现随水解的进行碱液的pH不断下降,并最终溶液pH<7达到6.5左右,说明乙酸乙酯水解会生成酸,酸碱中和导致溶液中的OH-不断减少,并最终呈现酸性。究其根本:是乙酸乙酯水解产生了乙酸,乙酸与氢氧化钠溶液反应,从而使得碱液的pH呈现如此变化。
该过程可用化学方程式分步表示: