【高中化学】用pH传感器探究盐酸滴定碳酸钠溶液
在《高中化学必修一》的学习中,我们学习了碳酸钠相关的知识。



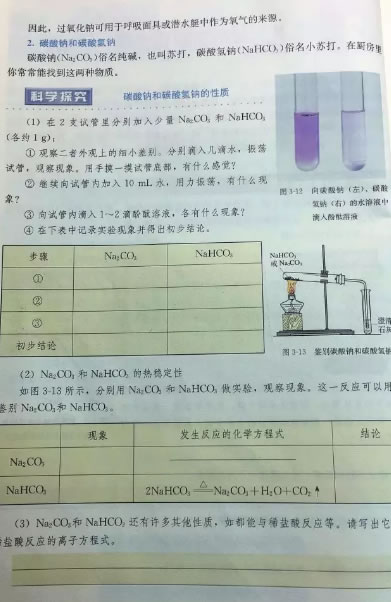

那么,用盐酸滴定碳酸钠会产生怎么样的实验效果呢?小队长带你一探究竟!
一、设计思路
通过学习相关知识,我们知道碳酸根在溶液中结合H+是分步进行的,也就是说溶液的CO32-先和H+反应生成HCO3-,之后HCO3-再和H+反应生成H2CO3进而分解为CO2和H2O。用离子方程式可以这样表示:
1、CO32-+H+=HCO3-
2、HCO3-+H+= H2O+CO2 ↑
那我们用强酸来滴定碳酸钠溶液时会出现两个滴定突越,实验是否如此呢?本实验我们用pH传感器一探究竟。
二、实验原理
标准状态下H2CO3的一级解离常数为Ka=4.45 ×10-7,二级解离常数为Ka=4.69 ×10-11, 根据酸碱质子理论可知CO32- 和HCO3-属于质子碱,且CO32-的碱性大于HCO3-,所以当溶液中存在H+时,CO32-会先和H+反应生成HCO3-,然后HCO3-再和H+反应生成H2CO3。如果用盐酸滴定碳酸钠溶液,会出现两个滴定突越。
三、实验流程
【实验用品】
实验试剂:0.1mol/L的盐酸、0.1mol/L的碳酸钠溶液。


实验仪器:滴数传感器、pH传感器、数据采集器、计算机、Logger pro软件、烧杯(100ml)、量筒(100ml)、磁力搅拌站、磁子、胶头滴管。


【实验步骤】
1. 将数据采集器、pH传感器、滴数传感器相连接,打开“LoggerPro” 软件。
2. 用100mL量筒量取20mL0.1mol/L的碳酸钠溶液放入洗净的 100ml 烧杯中,在烧杯中加入磁子。






3. 将100ml 烧杯磁力搅拌站上,调整pH传感器的位置,如下图所示,搭建实验装置。

4. 开始采集数据。在滴管中加入足量0.1mol/L的盐酸,等待pH示数稳定,打开滴管旋钮,开始滴定。
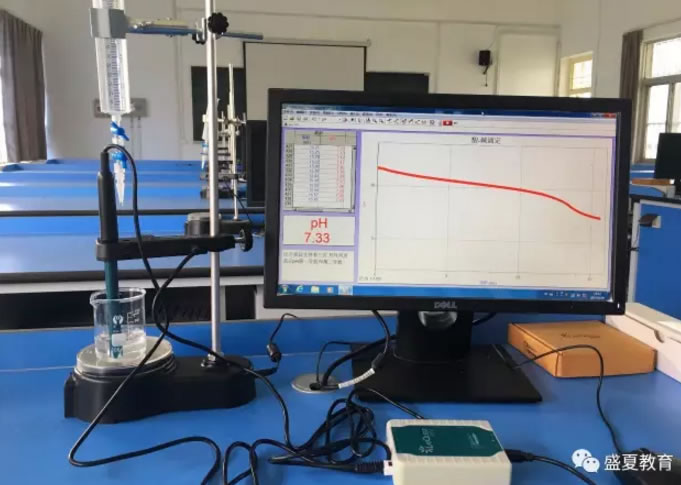
5. 待示数稳定,滴入体积约为40ml时停止采集。
6. 保存实验数据,清洗仪器,整理桌面。
四、实验现象
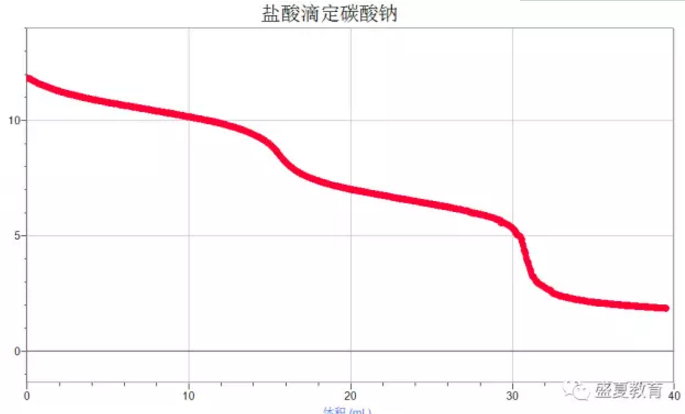
1. 观察曲线可以发现,溶液pH不断下降,且中间出现两个突越。


五、问题讨论
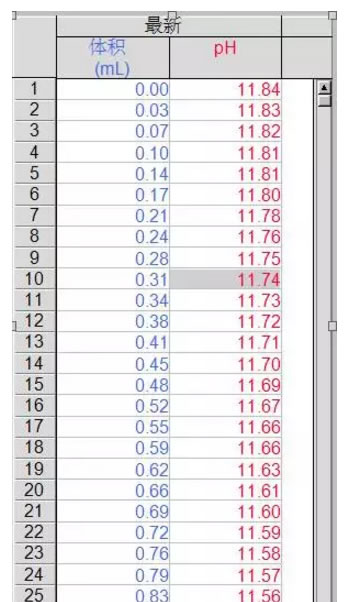
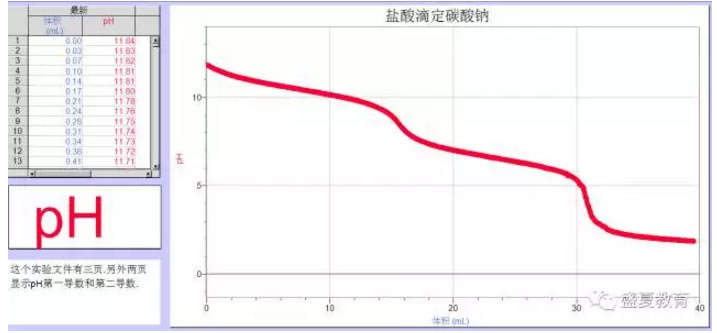
第一突越点:在第一突越点之前,溶液中的CO32-会先和H+反应生成HCO3-,在第一突越点时,溶液中的CO32-几乎全部变成HCO3-。
用离子方程式表示为:CO32-+H+=HCO3-
第二突越点:在第一突越点和第二突越点之间,溶液中的HCO3-和H+反应生成H2CO3进而分解为CO2和H2O。所以此阶段会看到大量气泡。用离子方程式表示为:HCO3-+H+= H2O+CO2 ↑
更多数字化实验资料、最新教育动态请关注:盛夏教育。

