【高中化学】通过稀硫酸与氢氧化钡溶液反应实验探究离子反应的实质
在高中阶段——高一化学必修一中,我们学习了离子反应章节,初步理解了离子反应的实质。





今天,就让实验小队长带大家一起,使用数字化实验仪器做一个实验,探究一下离子反应的实质。
一、设计思路
在之前的实验中我们已经多次使用过电导率传感器,我们知道电导率传感器可以检测溶液电导率以反映溶液中总的离子浓度的变化。离子反应的实质是溶液中 “某些离子浓度”的减少,而离子浓度的减少有会导致溶液导电率的变化,所以本实验借助电导率传感器测量反应过程中电解质溶液导电率变化情况,从而判断反应体系中离子浓度的变化,进而研究电解质在水溶液中反应的实质。

二、实验原理
稀硫酸与氢氧化钡溶液的反应是学生学习离子反应时接触较多的一个反应,其中发生的离子方程式为:
2H++SO42-+Ba2++2OH-=2H2O+BaSO4⬇
从离子方程式中我们能清晰地看出混合之前,硫酸溶液中存在离子H+、SO42-氢氧化钡溶液中存在离子Ba2+、OH-,当二者混合,由于水是弱电解质,硫酸钡是沉淀,所以H+和OH-会结合生成水,SO42-和Ba2+会结合生成硫酸钡,自然溶液中的离子浓度就会降低。对应的电导率也会下降。
三、实验流程
【实验用品】
实验试剂:0.002 mol/L 氢氧化钡溶液、0.03mol/L 稀硫酸溶液、蒸馏水。
实验仪器:滴数传感器、电导率传感器、数据采集器、计算机、Logger pro软件、烧杯、量筒(100mL、10mL)、磁力搅拌器、磁子、胶头滴管。




【实验步骤】
1. 将数据采集器、导电率传感器、计算机三者相连接,打开“LoggerPro” 软件。
2. 用100mL量筒量取30mL 0.002mol/L 氢氧化钡溶液放入洗净的 50mL 烧杯中,在烧杯中加入磁子。
3. 将烧杯放置到磁力搅拌器上。将装好标准硫酸溶液的酸式滴定管固定好待用。
4. 在滴数传感器中加入足量0.03 mol/L稀硫酸,固定在磁力搅拌器上,这是点击“校准”,对滴数传感器进行校准。
5. 校准好滴数传感器后,在点击“校准”对电导率传感器进行校准,然后将校准后的电导率传感器放入盛有氢氧化钡的烧杯中。

6. 如下图所示连接试验装置。打开磁力搅拌器,待示数稳定后,点击“开始”,打开滴数传感器开关,准备采集数据。

7. 待反应结束后停止采集,保存实验数据。
四、实验现象
1. 观察小烧杯可以发现,随反应的进行,溶液中出现了白色浑浊。
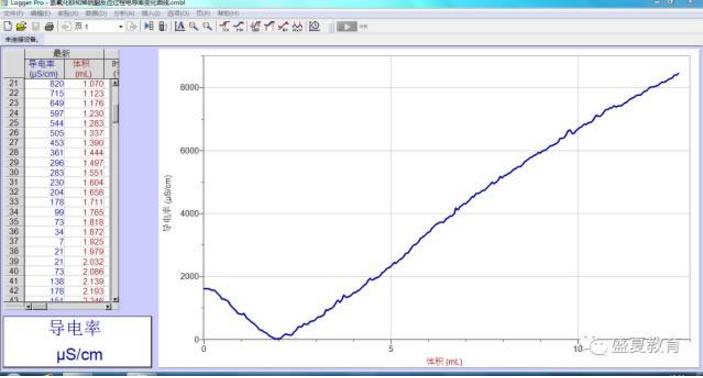
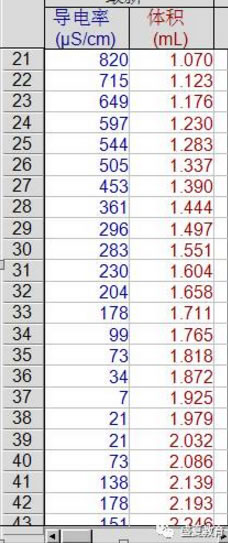
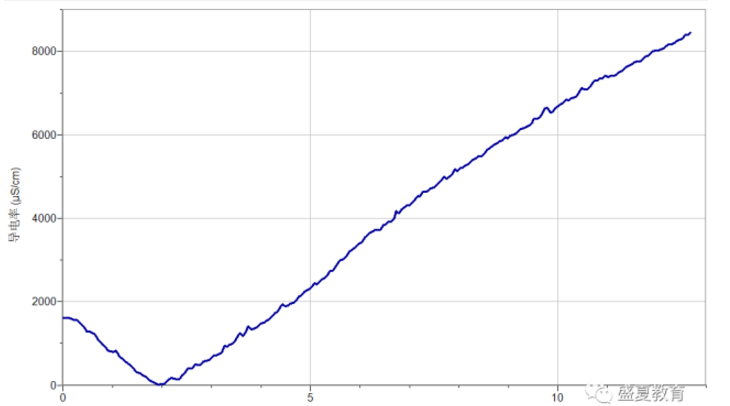
2. 观察曲线可以发现,溶液电导率随稀硫酸的加入电导率先降低,降低至零点,后又升高。


3. 曲线转折点对应的体积约为2mL。
图形记录:
五、问题讨论
1. 图形呈现V 字形,分析每一段图形的原因。
a. 起点:氢氧化钡属于强电解质,在水溶液中能够完全电离Ba(OH)2=Ba2++2OH-, 所以一开始0.002mol/L的氢氧化钡溶液的电导率为1606μs/cm。
b. 电导率下降阶段:当实验开始后,我们开始向其中滴入稀硫酸,由于硫酸也是强电解质,所以在水中会完全电离:H2SO4=H2++SO42-,当硫酸电离出的硫酸根和氢氧化钡电离出的钡离子相遇时,就会结合生成一种难溶物硫酸钡;同样的当硫酸电离出的氢离子遇到氢氧化钡电离出的氢氧根时,也会立即结合生成水,导致溶液中的离子浓度降低。Ba2++SO42-=BaSO4⬇;H++OH-=H2O
c. 拐点:在加入稀硫酸1.925mL时,电导率为7μs/cm,接近于0,此时溶液中几乎没有自由移动的离子,因为此时加入的硫酸恰好和氢氧化钡完全反应,溶液中的钡离子全部生成硫酸钡沉淀,氢氧根全部生成水,所以此时溶液电导率趋于0μs/cm。
d. 电导率上升阶段:硫酸也是强电解质,所以在水中会完全电离:H2SO4=H2++SO42-,所以在拐点之后,溶液电导率又开始上升。
2. 通过以上实验你对离子反应的实质如何理解?
我们知道,离子反应的实质就是溶液中某些离子浓度的减少。经过实验,我们能够从电导率的变化明显地“看到”溶液中离子的减少,从而更深刻透彻的理解离子反应的实质。


