课程设计——碳酸钙溶解过程中的电导率和pH变化
在初中化学课本中,同学们普遍把碳酸钙看成是不溶的物质。但是实际上,碳酸钙是微溶于水
的。为了证明这一点,我们设计了一组实验教学方案。
一、设计思路
化学是一门在分子、原子层面上认识物质组成、结构、性质及其变化规律的科学,宏观与微观
相联系是化学学科独特的思维方式,也是化学与其他学科的本质不同。学生通过中学化学课程
的学习,不仅仅要掌握化学知识,还要以这些化学知识的学习为途径掌握认识世界、解释世界
的基本思想方法和思维方式。在初中的学习中,我们把碳酸钙看成不溶的物质,在人教版九年
级化学教材给出的溶解性表中也明确表明碳酸钙是不溶于水的物质,由此学生就容易形成一种
观念,认为碳酸钙这类物质在水中是完全不溶的。但我们都知道,物质并没有绝对的不溶,只
是溶解度的大小差异不同而已,而溶解度的不同又于每种物质的沉淀溶解平衡密切相关。无论
是溶解度还是沉淀溶解平衡都有一种动态平衡的观念,这种观念贯穿化学学习的始终。如果学
生在初中阶段没有建立正确的前概念,那么在后续学习中就会产生认知冲突,造成学习难点。
二、实验原理
在做这个实验之前,需要向学生普及两个理论,即碳酸钙如果溶于水,为什么pH和电导率会同
时升高?
知识点拓展学习:1、碳酸钙溶于水之后,电离出的碳酸根水解,会使溶液变为碱性;2、电
导率是以数字表示的溶液传导电流的能力,溶液中的离子浓度越大,电导率则越大。
这两个知识点的原理都是高中课本的内容,在初中阶段并未深入探讨,这个实验可以激发学生
深入探究学习的兴趣,为以后高中阶段知识点的学习做好铺垫!
本次实验利用电导率传感器和pH传感器探究碳酸钙溶解过程中的电导率和pH变化,通过电导率
曲线的上升,可以让学生“看到”碳酸钙溶于水的过程,帮助学生理解课本上的“不溶”并不
是绝对的一点都不溶,而是相比溶解度较大的物质来说它的溶解度太小而已。溶解过程中的pH
变化更加辅助说明碳酸钙确实溶解这一事实,教师可以在这里补充说明CO32-水解能够使溶液
呈碱性,所以pH的不断升高说明了溶液中CO32-浓度的增加。
化学式表达为:
CaCO3=Ca2++CO32-
CO32-+H2O=HCO32-+OH-
传统实验可以定性,数字化实验可以定量。为了将传统实验的定性融入其中,我们最后利用酚
酞滴入溶液中,观察变化。
酚酞:其特性是在酸性和中性溶液中为无色,在碱性溶液中为紫红色。常被人们用来检测酸碱。
三、实验用品
实验仪器:
pH传感器、电导率传感器、LabPro数据采集器、电脑(Logger Pro)、磁力搅拌器、量筒
(100mL)、烧杯(250mL)、磁子。
实验药品:
碳酸钙、酚酞、去离子水。
四、实验步骤
1、操作
(1) 用量筒量取100mL蒸馏水,注入250mL的烧杯中,放入磁子,置于磁力搅拌器上。
(2) 如下图所示搭建实验装置,将pH传感器和电导率传感器放在烧杯中。

(3) 打开Logger Pro软件,对电导率传感器进行校准。
(4) 开始采集数据。
(5) 待示数稳定后,加入一药匙碳酸钙粉末,数据采集将持续150s,观察电导率和pH曲线有
何变化。

(6) 停止采集,静置。
(7) 取上层清液注入试管1中,滴加两滴酚酞试液,振荡,观察现象。
(8)结束实验,整理仪器。
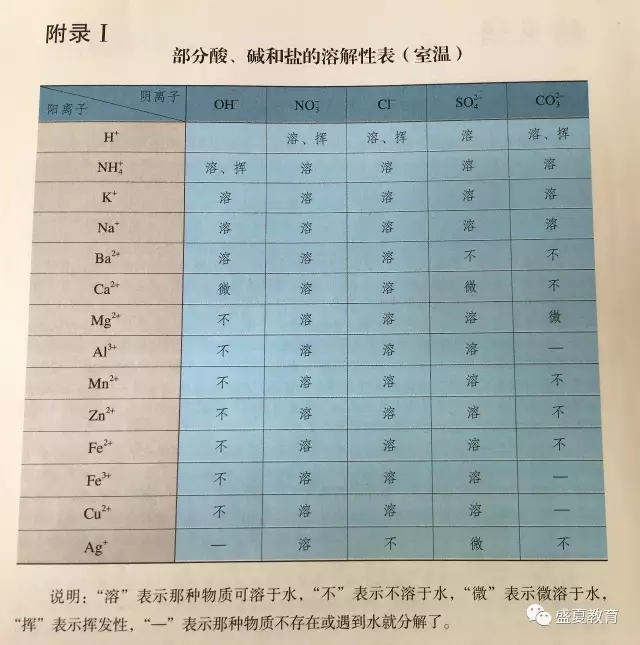
2、实验数据记录
具体数值见表1
表1 实验数据记录表
3、观察实验现象、结果
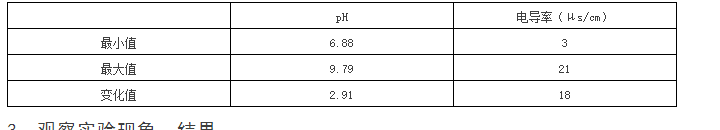
加入碳酸钙后pH变化曲线:
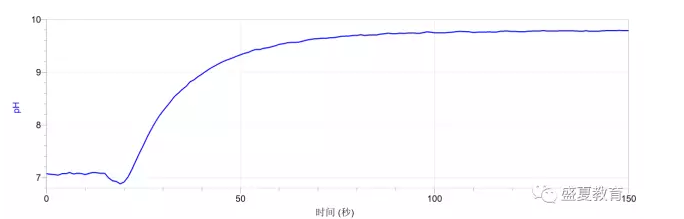
加入碳酸钙后电导率变化曲线:
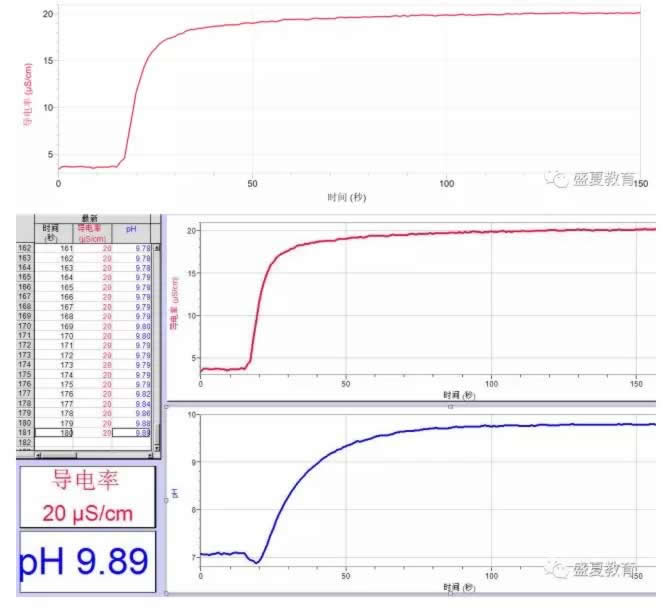 加入酚酞试液后:
加入酚酞试液后:

五、实验分析
1、 四重表征分析
具体内容见表2
表2 四重表征分析
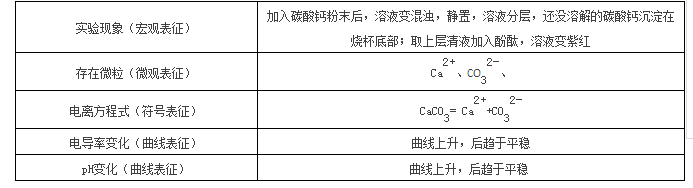
2、从电导率曲线上升可以看出碳酸钙的不断溶解。
3、 实验结束后,pH为9.79。是因为碳酸钙溶于水电离生成碳酸根,碳酸根水解使溶液呈碱性。
4、 实验结束后,电导率最大值为21μs/cm,自来水的电导率大约在200μs/cm左右,两者相比,
可以看出,虽然碳酸钙溶解,但是溶解度非常小,这也是课本上将他列为“不溶”的原因。经过查
阅资料可知:常温下溶解度为1g-10g之间属于可溶,0.01g-1g属于微溶,小于0.01g是难溶物,
也就是教材上的不溶。碳酸钙的溶解度常温下为0.003g因此属于难溶物。
5、可以看到取上层清液向其中滴加酚酞使溶液变紫红,也可以推测出溶液呈弱碱性。
六、实验结论
该实验用电导率和pH传感器探究了碳酸钙的溶解过程,证明碳酸钙在常温下能够极少量溶于
水,属于难溶物。曲线表征可以帮助同学看到这一微观变化过程,有利于学生建立动态平衡的基
本观念。很简单的小实验即能帮助教师更好的处理该知识点的教学,又能科学直观的反应事实,
帮助学生建立正确的学科基本观念,有利于提升学生的科学素养。
更多数字化实验资料、最新教育动态请关注:盛夏教育。

