小实验——用pH传感器测定判断碳酸钙微溶于水的性质
引读:在上一篇文章中,小队长给大家推送了碳酸钙溶解过程中的电导率和pH变化的课程
设计,帮助老师们更好地教学。但是在初中化学课程里并未引入关于电导率的知识。于是,
我们重新做了一个简化的实验,只引入pH,以此来判断碳酸钙微溶于水的特性,帮助学生简
单地理解其概念。
一、实验原理:
碳酸钙溶于水之后,电离出的碳酸根水解,会使溶液变为碱性;
化学式表达为:
CaCO3=Ca2++CO32-
CO32-+H2O=HCO32-+OH-
二、实验用品
1、数据化实验仪器:
数据采集器、

pH传感器

磁力搅拌站


2、药品:蒸馏水、酚酞、碳酸钙粉末。

3、容器和工具:烧杯、药匙、滴管等。
三、实验装置:

四、实验步骤:
1、取200mL蒸馏水,注入250mL的烧杯中,置于磁力搅拌器上;
2、 如上图所示搭建实验装置,将pH传感器放在烧杯中;
3、将pH传感器、搅拌站连接至数据采集器,再将数据采集器连接至电脑;
4、打开Logger Pro软件,点击采集按钮,开始采集数据。采集蒸馏水的pH。
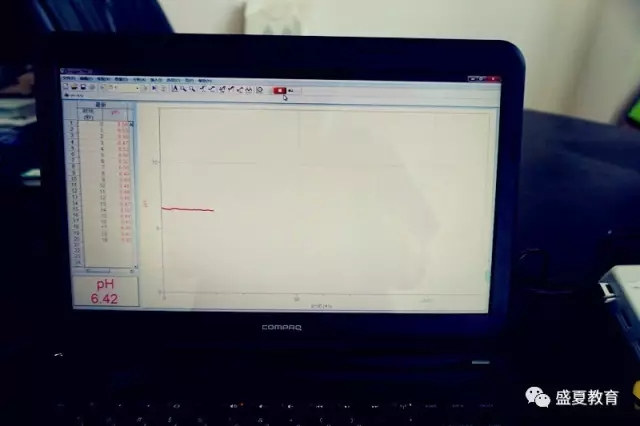
5、待数据稳定后,往烧杯里加一药匙碳酸钙粉末,并同时打开搅拌站,速度调节至最大,我们
可以看到碳酸钙粉末迅速扩散,使得溶液变浑浊;

6、观察pH曲线有何变化。
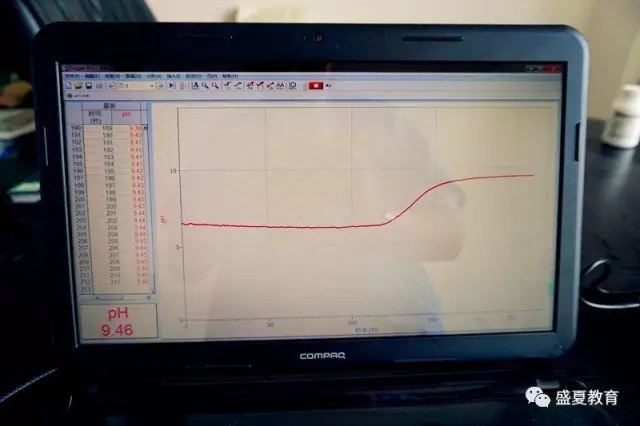
7、待数据稳定后,停止采集,并保存实验文件。
8、往烧杯中滴入酚酞,观察溶液的变化,我们可以看出,溶液变红。

五、实验总结
1、表格数据
由图可见,随着加入碳酸钙粉末,溶液的pH在逐渐上升直至平稳。
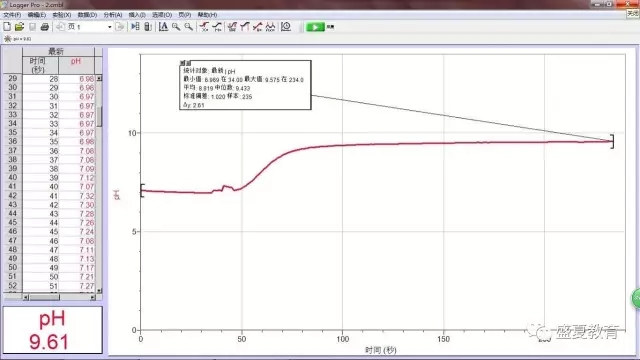
2、总结:从实验数据可以判断,蒸馏水在加入碳酸钙粉末后pH的确升高了,呈碱性。酚酞滴入后
的溶液呈紫红色,也判断溶液为碱性。这是因为碳酸钙溶于水电离生成碳酸根,碳酸根水解使溶液
呈碱性。所以由此推断,碳酸钙可以溶于水,并非完全不溶。
关于初中化学实验,我们将推出更多数字化实验设计,帮助老师们更好地教学!
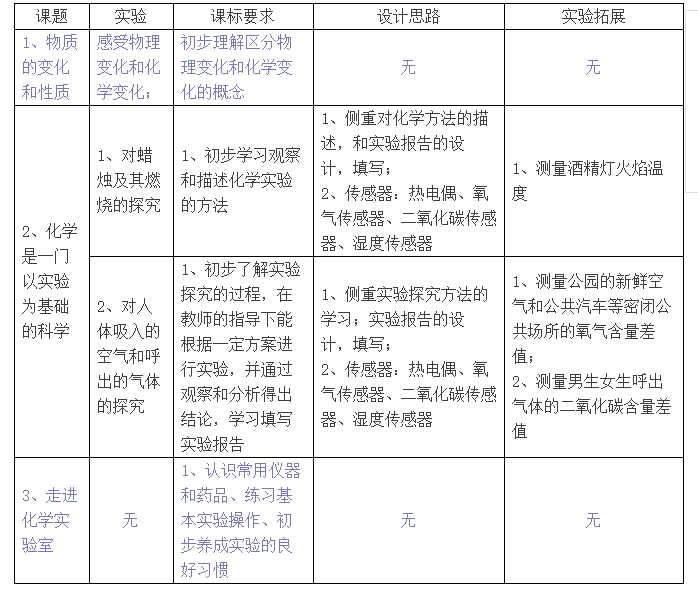
课程设计的提纲为:

课程设计纲要展示:
初中化学
第一单元 走进化学世界
更多数字化实验资料、最新教育动态请关注:盛夏教育。

