测定碘酸钾与碘化钾反映所需pH范围
教科书中加碘食盐中碘元素的监测,是利用KIO3与KI在酸性条件下的反应,通过淀粉指示剂的变蓝来证明食盐中是否含有碘元素。但我们并不清楚KIO3与KI是在多大的PH范围内才会发生反应。基于此,设计了测定KIO3与KI反应所需的PH大概范围的实验。
一、实验目的:
1.掌握滴数传感器和PH传感器的实时监测功能。向加有淀粉的一定体积食盐和KI混合溶液中,不断滴加一定浓度的H2SO4溶液。当溶液变蓝时,停止滴定,并得到此时溶液的PH值。
2.掌握IO3-和I-在酸性条件下发生归中反应的原理。
二、实验背景
碘盐是指含有碘酸钾的食盐。由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,所以国家强制给食盐中加入少量的碘。由于KI容易被氧化变质,因而食盐中的碘元素是以碘酸钾的形式存在的。
三、实验原理
碘元素的测定利用KIO3+ 5KI +3H2SO4=3I2 +3H2O +3K2SO4即IO3-和I-会在酸性条件下归中成I2和H2O。当H2SO4不断滴入食盐和KI及淀粉的混合溶液时,PH传感器会不断监测溶液PH的降低,当溶液变蓝时,即反应开始生成I2,此时溶液的PH即为该反应发生所需的PH的临界值。
四、实验仪器和药品
药品:家用食盐、PH约为3的H2SO4、KI、淀粉
实验仪器:采集器、软件系统、PH传感器、滴数传感器、量筒、磁力搅拌器、玻璃棒、天平、烧杯、胶头滴管。
实验装置图:

五、实验步骤
1.将PH传感器与滴数传感器和采集器以及电脑连接好,打开软件。
2.称取10g的碘盐放入烧杯,加水配成100ml的溶液,并加入1g碘化钾固体和少量淀粉,搅拌至完全溶解。
3.将该烧杯放置在磁力搅拌器上(烧杯壁贴上白纸,便于观察溶液变色),将PH传感器浸入溶液,并固定在滴数传感器上。打开磁力搅拌器。
4.将配制好的PH约为3的稀 H2SO4溶液(用PH传感器测定)装入塑料试剂库后进行滴定(滴数传感器不需要校准,本实验不涉及到计算,但要控制较慢的滴速),点击。
5.到溶液变蓝时停止滴定。记录此时溶液的PH值。
六、实验数据
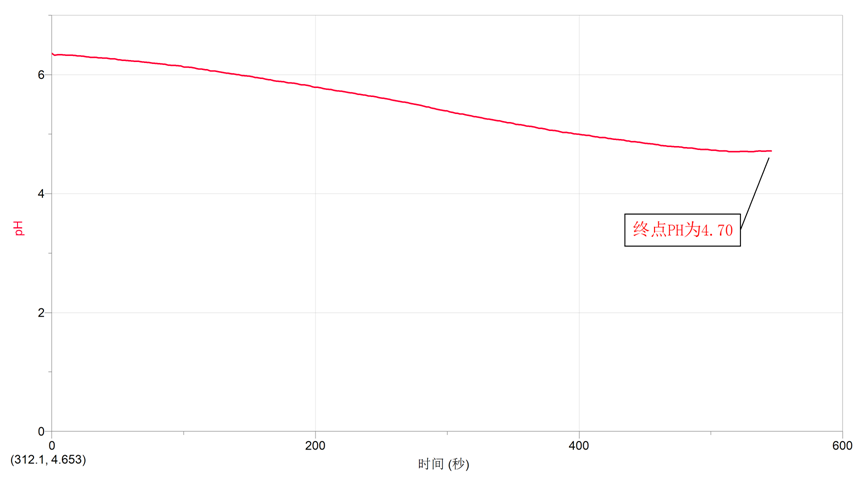
七、交流讨论
1.进行该实验时,如果硫酸的浓度过大或者滴定速度过快,对实验的观察会有什么影响?
2.滴定接近终点时,溶液的PH值趋于稳定,请分析原因?