硫酸亚铁晶体纯度的测定
本实验利用含有一定质量FeSO4晶体的溶液来代替补铁药品,用酸性KMnO4滴定FeSO4溶液,在检验亚铁离子同时,还可以测定FeSO4晶体的纯度。
一、实验目的
1. 学习并掌握滴数传感器和氧化还原电势传感器的使用方法。利用已知浓度的酸性KMnO4滴定含有一定质量FeSO4晶体的溶液,通过电势的突变确定滴定终点。
2. 认识氧化还原滴定中电势突跃的存在,加深理解氧化还原滴定方法的原理。
3. 掌握氧化还原滴定的计算方法。
二、实验背景
市场上绝大多数的补血药品的主要成分都是亚铁盐,比如葡萄糖酸亚铁、乳酸亚铁、硫酸亚铁等等。Fe2+离子是一种还原性很强的离子,很容易被氧化变质,因而补铁药品中同时含有大量的维生素C来延缓亚铁盐的变质。
实验室测定亚铁盐的纯度通常是利用氧化还原滴定的原理。利用已知浓度的酸性KMnO4滴定一定体积含有亚铁盐溶液,以此来计算亚铁盐的含量或浓度。由于补铁药品中含有的维生素C也会消耗酸性KMnO4,且不确定一支补铁口服液中维生素的具体含量(考虑维生素C的变质)。因而利用FeSO4晶体来代替补铁口服液,以此来模拟实验室测定补铁药物中亚铁盐的含量。
三、实验原理
酸性KMnO4滴定Fe2+发生反应的离子方程式为:MnO4- + 5Fe2+ + 8H+= Mn2+ + 5Fe3+ + 4H2O。随着滴定的进行,还原性离子浓度降低,氧化性离子浓度增大,电势会慢慢升高。当Fe2+被完全氧化之后,再滴入强氧化性的酸性KMnO4,离子的电势会瞬间突变(增大),此时意味着反应终点已经到达。可以在图像中找到滴定终点所消耗的酸性KMnO4的准确体积,代入公式:5C(KMnO4) · V(KMnO4) · 10 -3 · M(FeSO4) / m(样品) ×100 ﹪便可计算出FeSO4晶体的纯度。
四、实验仪器和药品
实验药品:0.05mol/L酸性KMnO4、FeSO4晶体、蒸馏水
实验仪器:烧杯、铁架台、 150ml烧杯、磁力搅拌器、滴数传感器、氧化还原电势传
感器、数据采集器
实验装置图:

五、实验步骤
1.准确配制0.05mol/L酸性KMnO4溶液;
2. 称取0.5gFeSO4晶体,加入约100ml水溶解于烧杯中;
3.安装好磁力搅拌器,接通电源。将烧杯放在磁力搅拌器上,并放入磁籽;
4.将滴数传感器固定在磁力搅拌器上,取出氧化还原电势传感器,用蒸馏水冲洗之后固定在滴数传感器上,保证底部的玻璃珠完全浸没在溶液中且与磁籽有一定的距离;
5. 安装金属夹在滴数传感器的上方,将装有约50ml酸性KMnO4溶液的塑料试剂库用夹子固定好。保证其尖嘴处正置于滴数传感器上方;
6.打开磁力搅拌器,点击,然后将塑料试剂库上方的阀门打开(下方的阀门用于控制滴速);
7.观察图像变化,待到电势曲线发生突变时,可关闭上方的阀门,停止滴定,同时停止采集。
六、实验数据
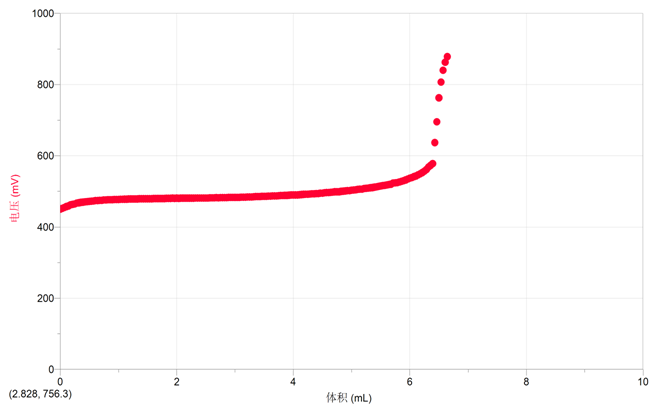
图一
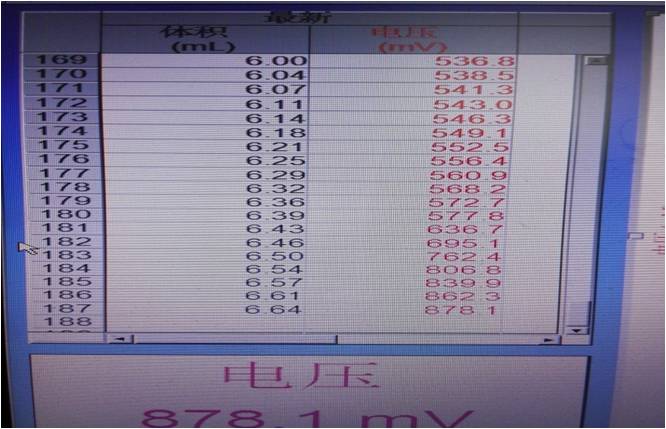
图二
从图二中可以找出,当酸性KMnO4滴入6.39ml时,终点达到。通过计算得出该FeSO4晶体纯度为48.56﹪(以FeSO4计)
七、交流讨论
1.和传统滴定实验比较,该实验有哪些优势?
2.观察滴定曲线,它有什么特点?如果向酸性KMnO4溶液中滴定FeSO4溶液,滴定曲线应该是什么形状?