探究过氧化钠与二氧化碳的反应
一、实验目的
1.掌握氧气传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映过氧化钠与二氧化碳反应中氧气的生成曲线。
2.认识过氧化钠与二氧化碳反应中必须有水存在,加深对该反应原理的理解。
3.掌握氧气变化曲线可用作研究过氧化钠与二氧化碳反应,并对其进行数学建模以及进行相关探讨。
二、实验背景
过氧化钠与二氧化碳反应的实质是过氧化钠先与水反应生成氢氧化钠与氧气,氢氧化钠再与二氧化碳反应生成碳酸钠。但从反应现象上很难看出这一点,通过数字化实验和氧气传感器,探究过氧化钠与干燥和未干燥的二氧化碳反应,从产生氧气的百分含量上可以很直观的看出过氧化钠与干燥的二氧化碳不反应,从而突破难点,帮助学生认清反应本质。
三、实验原理
过氧化钠与水发生氧化还原反应,过氧化钠做氧化剂,水做还原剂,生成的氢氧化钠再与二氧化碳反应生成碳酸钠和水。
2Na2O2 + 2H2O == 4NaOH + O2↑
2NaOH + CO2 == Na2CO3 + H2O ‚
+‚ 2Na2O2 + CO2 == Na2CO3 + O2↑
四、实验仪器、药品、装置图
实验药品:0.1000mol/L盐酸溶液、大理石、过氧化钠、浓硫酸。
实验仪器:采集器、软件系统氧气传感器、三颈烧瓶、圆底烧瓶、试管、玻璃导管、广口瓶、长颈漏斗。
实验装置:如下图所示。

五、实验步骤
1.检查装置气密性。
2.向圆底烧瓶中加入一定量的大理石,在细口瓶中装入一定量的过氧化钠粉末,连接好装置。
3.将氧气传感器固定于试管口,并连接好数据采集器和电脑,将氧气传感器归零。
4.向分液漏斗中加入一定量0.1000mol/L盐酸溶液,浸没漏斗颈底部,收集数据。
5.完成采集后,处置反应中的混合物,清洗仪器。
6.利用软件处理得出过氧化钠与二氧化碳反应产生的氧气曲线并加以分析。
7.在反应装置和装有过氧化钠的细口瓶之间链接一个装有浓硫酸的洗气瓶,重复之前的操作,收集数据并分析。
六、交流讨论
1.观察氧气曲线,它有什么特点?
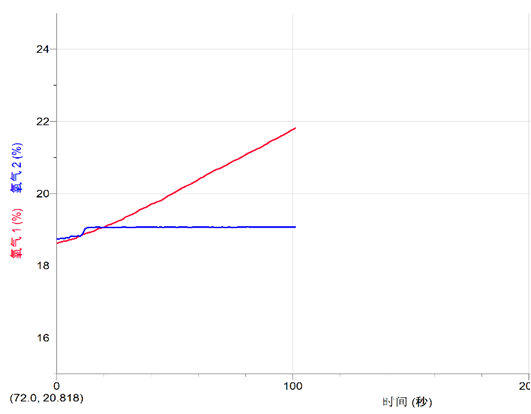
过氧化钠与湿润的二氧化碳反应(红线)
过氧化钠与干燥的二氧化碳反应(蓝线)
2.为什么干燥的二氧化碳与过氧化钠也反应生成了氧气?哪些因素干扰了实验结果?如何确保实验环境中绝对干燥?
3.过氧化钠与湿润的二氧化碳很快反应并生成大量氧气,过氧化钠与干燥的二氧化碳不反应,但是无法保证实验装置的绝对干燥,由于空气中有水蒸气存在,所以,最终还是反应生成了氧气,但是由于水蒸气较少,所以产生养的的速率和量都较低。可以间接说明过氧化钠与湿润的二氧化碳反应。
七、利用数字化实验进行实验探究的优势
通过氧气传感器检测过氧化钠与二氧化碳反应过程中氧气的生成,并由计算机显示数据和曲线,即可直观地反映出过氧化钠与二氧化碳反应过程中氧气的变化情况。具有简单、便捷、准确的优点,使不易观察到的实验现象更加直观。