氯气与溴、碘的氧化性比较
一、实验目的
1.掌握色度传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映氯水在氧化还原反应中颜色的变化。根据氯水在氧化反应中颜色的变化推断反应的发生
2.认识氯水的氧化性
3.分析比较Cl2、Br2、I2的氧化性强弱
二、实验背景
氯气具有很强的氧化性,可以氧化很多物质。实验室经常使用氯水代替氯气进行实验,因为水中含有大量的Cl2分子。验证氯水的氧化性可以根据溶液颜色的变化判断。如氯水将I-氧化为I2,Cl2做氧化剂生成还原产物Cl-,I-做还原剂生成氧化产物I2,I2溶于水形成碘水,两种卤素单质水溶液颜色间的变化可以判断反应的发生与否。但是,颜色的变化有时比较微弱,肉眼观察带来难度,颜色的变化时间极短,通过肉眼的观察不容易捕捉。基于以上两点考虑,使用色度传感器可以监测反应过程中的颜色变化。
三、实验原理
Cl2具有很强的氧化性,根据氧化还原理论,氧化剂的氧化剂强于氧化产物,还原剂的还原性强于还原产物,判断氧化剂与氧化产物的氧化性以及还原剂和还原产物之间的强弱关系。反应往往伴随着微弱的颜色变化。如Cl2与KI溶液间的反应,如果Cl2能将I-氧化为I2,由于碘水颜色比氯水更深,反应前后,溶液颜色加深,溶液的吸光率增大,透光率减小。若如果Cl2不能将I-氧化为I2,由于无色KI溶液的混合,使淡黄绿色氯水溶液颜色减弱,结果使溶液的吸光率减小,透光率增大。综上所述,可以根据溶液反应过程中透光率的变化判断反应的发生。再如Cl2与KBr溶液间的反应,由此类推也可判断反应是否能。,希望以此为突破口,找到Cl2氧化性强弱判断的有力证据。
四、实验仪器、药品、装置图
(1)实验仪器:采集器、软件系统、色度传感器,比色皿,胶头滴管。
(2)实验药品:饱和氯水,0.1 mol/LKI溶液,0.1 mol/LKBr溶液。蒸馏水。
(3)实验装置图

五、实验步骤
1.向比色皿中中注入适量蒸馏水(超过比色皿的一半),并连接好数据采集器和电脑和色度传感器,比色皿的波长选择565nm,点击色度传感器上的“CAL”按钮,进行较零。注意溶液的颜色就是光能通过的颜色。应该选用一个与透过不同的颜色来来观察吸收光的颜色。紫色 (430 nm)、兰色 (470 nm)、绿色 (565 nm)、红色 (635 nm)。通过观察溶液的颜色判断,在反应物和生成物中都没有红色,所以选用565nm的红色波长适合本实验。做其他实验时,请根据实验实际进行适当调整,选择合适的测定波长。
2. 移取与蒸馏水等量的饱和氯水,待数据稳定后点击“采集”按钮同时,向比色皿中滴加KBr溶液测定溶液的吸光率随时间的变化,如待吸光率稳定后停止采集图1所示。
3. 移取与蒸馏水等量的饱和氯水,待数据稳定后点击“采集”按钮同时,向比色皿中滴加KI溶液测定溶液的吸光率随时间的变化,待吸光率稳定后停止采集如图2所示。
六、交流讨论
1.为什么饱和氯水滴加KI、KBr后吸光率升高,透光率下降?
3,从以上实验中可以得出那些结论:Cl2和I-能反应吗?Cl2和Br-能反应吗?
4,通过以上实验结论得出Cl2,I2,Br2氧化性强弱关系是什么?通过以上实验结论得出Cl-,I-,Br-还原性强弱关系是什么?
七、利用数字化实验进行实验的优势
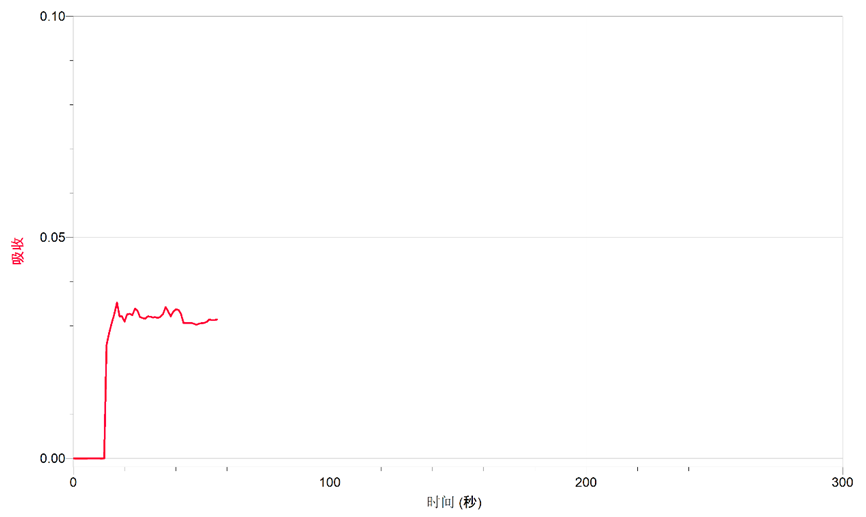
图1.KBr溶液中滴加饱和氯水
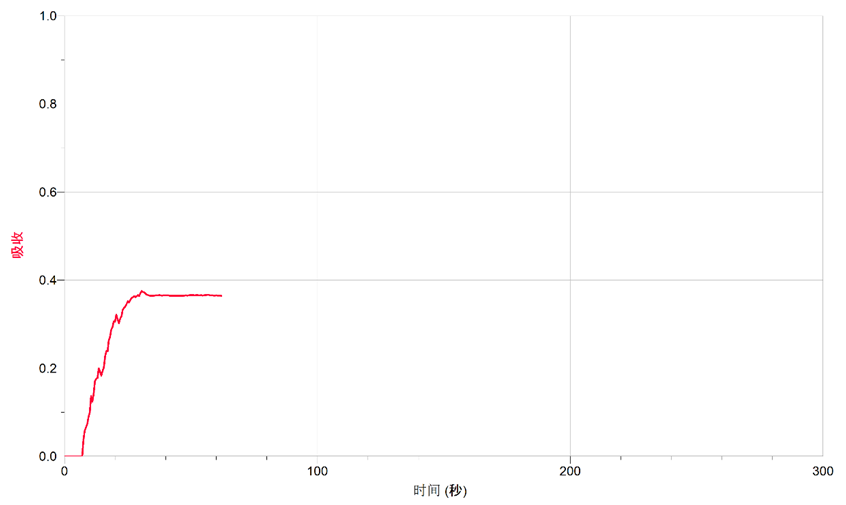
图2. KI溶液中滴加饱和氯水
从图中所给信息,可以得出结论。在KI、KBr溶液中滴加饱和氯水的过程中,均是溶液的吸光率升高。这证明了Cl2和KI、KBr溶液均发生了反应,反应分别生成了Br2、I2,Br2与I2溶于水形成的溴水和碘水使溶液颜色发生改变,导致透光率下降吸光率上升的结果。由于采用的是饱和氯水,KBr和KI溶液的浓度都是一致的,从吸光率的数值上看,I2水的吸光率远高于Br2的吸光率。这是因为碘水颜色较溴水颜色更深导致的。从以上实验得出结论:Cl2可以氧化I-和Br-。
Cl2+2 I-==I2 + 2Cl-
Cl2+2 Br-==Br2 + 2Cl-
根据氧化剂氧化性大于氧化产物,可以得氧化性Cl2强于Br2,I2 。根据氧化还原反应中,氧化性的氧化性越强,生成的还原产物的还原性越弱。可以得出Cl-,Br-,I-的还原性强弱关系,I->Cl-,Br->Cl-。