离子反应实质的研究
一、实验目的:
1. 掌握pH传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映中和反应过程中pH的变化。
2.了解反应过程中pH随加入硫酸体积的实时变化情况,更好地追踪反应的过程。
3.通过pH的具体数值判断中和反应的终点,从而找出氢氧化钡和硫酸反应时的物质的量之间的关系,更好地理解“在化学方程式中系数之比等于物质的量之比”。
4.掌握导电率传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映中和反应过程中导电率的变化。
5.通过导电率变化的具体数值判断滴定反应的终点,从而更加精确地判断反应物量的关系。
二.实验背景
稀硫酸与氢氧化钡的反应在课本中被用来验证电解质子水溶液中的反应,通过导电性的减弱来证明电解质在水溶液中的反应就是离子间的反应。该实验具有现象明显、操作简单的特点。但是该实验只能够定性的判断实验进行的大致程度,不能够定量的进行判断,不能够准确的指示出反应的终点,因此对实验进行程度的反应就不够精确。
三、实验原理
稀硫酸与氢氧化钡的反应属于中和反应,反应的方程式可表示为:
H2SO4+Ba(OH)2= BaSO4+2H2O
Ba(OH)2溶液呈碱性,若向其中加入稀硫酸会使其碱性逐渐减弱,中和反应进行完全时其pH应接近7,因此可借助pH传感器实时监测反应过程中的pH来达到了解反应进行程度的目的。
四、实验药品和仪器
(1)实验药品:0.01mol/L Ba(OH)2溶液、0.2 mol/L硫酸溶液
(2)实验仪器:采集器、软件系统、pH传感器(已用标准缓冲液邻苯二甲酸氢钾溶液进行校准,pH=4.00)、滴数传感器(在本实验中通过校准,20.77滴为1 mL)、磁力搅拌器、500mL小烧杯、滴定管、导电率传感器
(3)实验装置图


五、实验步骤:
(一)用pH传感器研究该反应的实质
1.用标准缓冲溶液校正pH传感器,通过滴数传感器校正滴定管滴出的一滴液体的体积。
2.使用移液管移取34.28 mL0.01 mol/L Ba(OH)2溶液转移到烧杯中,
3.向烧杯中放入小磁子,将烧杯放在磁力搅拌器上,开始搅拌。
4.在滴定管中注入约20mL 0.2000 mol/L的硫酸(无需排气泡和读刻度,所用标准液体积由滴数传感器自动给出)。
5.再将洁净的pH传感器插入烧杯中的氢氧化钡溶液中,并连接好数据采集器和电脑。
6.开始滴定并收集数据。
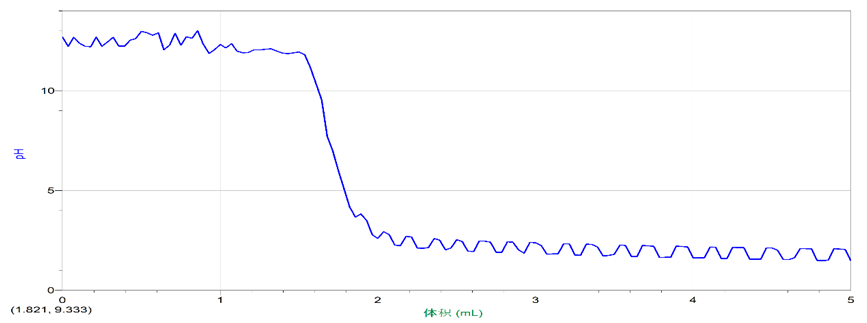
7.完成滴定后,处置反应中的混合物。用蒸馏水冲洗pH传感器,清洗仪器。
8.对所得曲线进行分析
(二)用导电率传感器研究该反应的实质
1.使用移液管移取50.00mL0.01 mol/L Ba(OH)2溶液转移到烧杯中,
2.向烧杯中放入小磁子,将烧杯放在磁力搅拌器上,开始搅拌。
3.在滴定管中注入约一定量20mL 0.01mol/L的硫酸(无需排气泡和读刻度,所用标准液体积由滴数传感器自动给出)。
4.再将洁净的导电率传感器插入烧杯中的氢氧化钡溶液中,并连接好数据采集器和电脑。
5.开始滴定并收集数据。
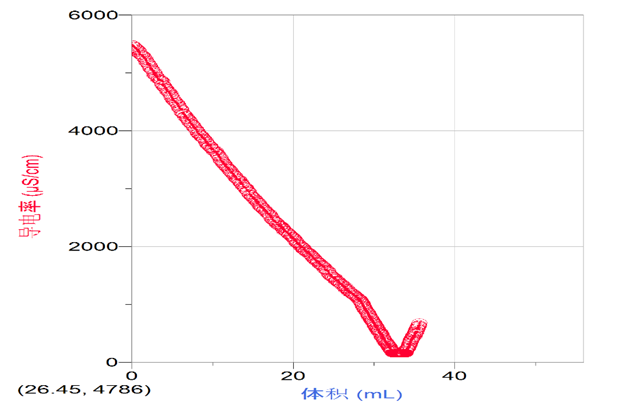
六、交流与讨论
1.观察滴定曲线,它有什么特点?如果向Ba(OH)2溶液中匀速滴入硫酸,请你预测滴定曲线应该是什么形状?
2.根据Ba(OH)2溶液和硫酸溶液的浓度及实际参与反应的体积算出其物质的量,并根据化学方程式:H2SO4+Ba(OH)2= BaSO4+2H2O
思考:化学方程式中的系数之比与实际反应的物质的量之间存在什么关系?
七、利用数字化实验进行实验的优势
可以用曲线直接读出pH与导电率的变化曲线,课堂教学中,学生曲线形成原因进行分析,提高学生思维水平。