醋酸溶液的电离度的测定
实验测定醋酸溶液的电离度随浓度变化的改变
(指导老师 张颖)
一、实验目的
1.掌握pH传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映中和反应过程中pH的变化。
2.认识电离度与浓度关系,加深理解电离度的概念。
二、实验背景
电离度是反映如电解质电离程度,但很多学生会将其影响因素与电离常数的影响因素混淆,不易理解加水稀释电离度增大, 该实验可从数据对比上直观的看到浓度减小电离度增加.
三、实验原理
醋酸(CH3COOH或HAc)是弱电解质,在水溶液中中存在以下电离平衡:
HAc H+ + Ac—
其平衡方程式为 c为HAc的起始浓度,[H+]、[Ac-]、[HAc]分别为H+、Ac-、HAc的平衡浓度,α为电离度,Ki为电离平衡常数。
在纯的HAc溶液中,[H+]=[Ac-]=cα,[HAc]=c (1-α)。则
根据以上关系,通过测定已知浓度的HAc溶液的pH,就知道其[H+],从而可以计算该HAc溶液的电离度。
配制不同浓度的醋酸溶液分别用PH传感器测定溶液PH值,换算成 [H+]。
用传pH传感器滴定过程中pH值如下图
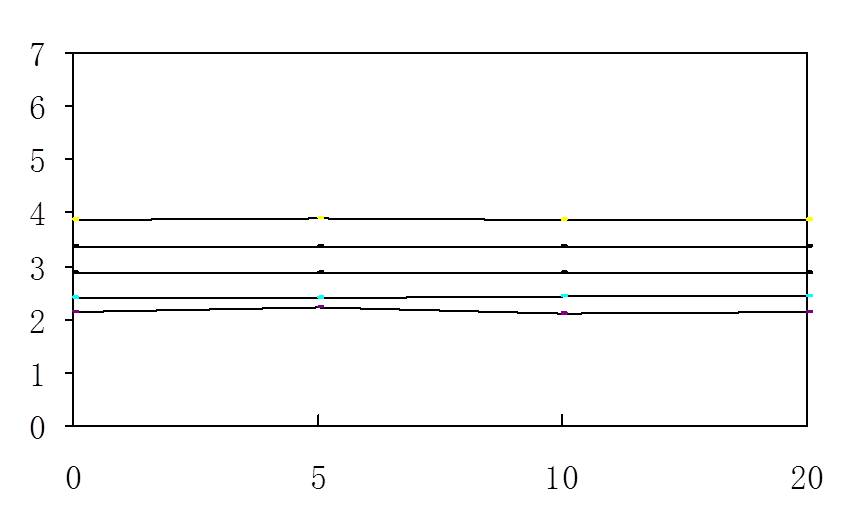
|
醋酸浓度 |
PH值 |
[H+] |
电离度 |
|
10mol/L |
2.14 |
0.0072 |
0.072% |
|
1 mol/L |
2.42 |
0.0038 |
0.38% |
|
0.1mol/L |
2.88 |
0.00134 |
1.34% |
|
0.01 mol/L |
3.38 |
0.00042 |
4.24% |
|
0.001 mol/L |
3.88 |
0.000134 |
13.4% |
四、实验仪器和药品
实验药品:冰醋酸、蒸馏水
实验仪器:采集器、软件系统、pH传感器、100mL小烧杯、、移液管、250ml容量瓶、100ml容量瓶、玻璃棒、胶头滴管、蒸馏水洗瓶。
实验装置:如下图所示。

五、实验步骤
1.用标准缓冲溶液校正pH传感器
2.分别配制0.1mol/L、0.01mol/L、0.001mol/L醋酸
3.常温下,用 pH传感器分别依次测定0.001mol/L、0.01mol/L、0.1mol/L醋酸溶液PH值
4. 根据以上PH值数据,换算出三种溶液的[H+],计算出电离度
六、交流讨论
1.测定不同浓度的醋酸溶液时,有测量的顺序要求吗?
2. 改变所测醋酸溶液的温度,则电离度有无变化?若有变化,会有怎样的变化?
七、利用PH传感器测定弱电解质的电离度与浓度关系的优势
电离度的测定,常用的方法有三种PH值法,电导法和目视比色法。
目视比色法有人为主观因素,相对误差较大,电导法受温度的影响较大,且还有水的电离影响,也不适合。PH值方法与溶液浓度配制的精准和温度有关,但PH值方法对于中学生相对较熟悉,原理简单、相对误差较小。比较适合中学生使用。