测定氢氧化钠溶液的浓度及酸碱滴定曲线
实验测定氢氧化钠溶液的浓度及酸碱滴定曲线
(指导老师 任峰)
一、实验目的
1.掌握pH传感器的实时检测功能,并借助数据采集器和计算机直接生成数据曲线,便捷、直观地反映中和反应过程中pH的变化。
2.认识中和滴定中pH突跃的存在,加深理解酸碱中和滴定方法的原理。
3.掌握pH变化曲线可用作研究酸、碱中和反应,并对其进行数学建模以及进行相关探讨。
二、实验背景
pH的突跃是酸碱中和滴定过程的重要特点,对于选择合适的酸碱指示剂以及该分析方法的准确性具要重要意义。但学生不易理解教材中讲述的“当接近滴定终点(pH=7)时,很少量(0.04mL,约1滴)的碱或酸就会引起溶液pH突变(人教版选修四)”,更难理解为何指示剂的变化点不在pH=7处,却可以用来指示反应的化学计量点。因此老师在教学环节常会引申介绍pH突跃的存在,但这一内容又会成为学生理解的一个难点。
三、实验原理
用已知物质的量的浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。常规的酸碱中和滴定是利用指示剂的变色来判断中和滴定的终点(即等当点),这要求操作者对于指示剂颜色变化十分敏感。本实验通过pH传感器和滴数传感器,监测盐酸与氢氧化钠溶液中和反应过程中pH变化,可以加入过量的标准液,不必关心滴定终点。滴定终点可以通过分析滴定曲线得出,从而使得滴定终点的判断更加简单、准确。
盐酸与氢氧化钠溶液中和反应的离子方程式为:
H++ OH−= H2O
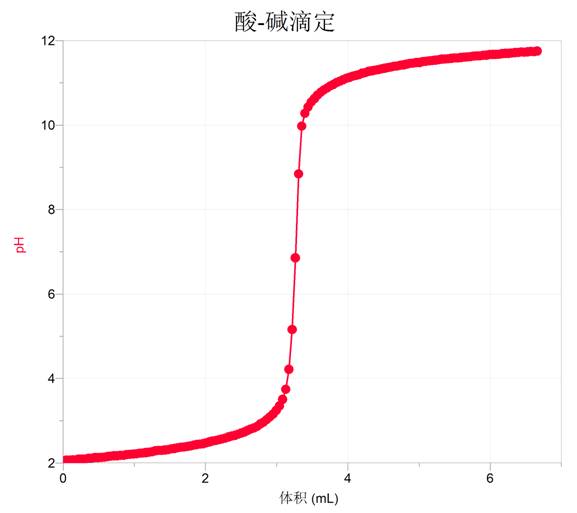
用传pH传感器滴定过程中pH变化如下(本图是用碱滴定酸,后面的图都是基于此图得出):
四、实验仪器和药品
实验药品:0.1000mol/L盐酸溶液、未知氢氧化钠浓度溶液(浓度为0.1mol/L左右)、pH标准缓冲溶液(pH= 6.865、pH=9.180)、酚酞溶液。
实验仪器:采集器、软件系统、pH传感器(已用标准缓冲液邻苯二甲酸氢钾溶液进行校准,pH=4.00)、滴数传感器(在本实验中通过校准,20.77滴为1 mL)、磁力搅拌器、100mL小烧杯、滴定管、移液管、250mL容量瓶、玻璃棒、胶头滴管、蒸馏水洗瓶。
实验装置:如下图所示。
五、实验步骤
1.用标准缓冲溶液校正pH传感器,通过滴数传感器校正滴定管滴出的一滴液体的体积。
2.使用移液管移取25.00 mL待测氢氧化钠溶液转移到烧杯中,并滴入2~3滴酚酞溶液(用以对照酚酞溶液褪色时的pH)。
3.向烧杯中放入小磁子,将烧杯放在磁力搅拌器上,开始搅拌。
4.在滴定管中注入约30mL 0.1000 mol/L的盐酸(无需排气泡和读刻度,所用标准液体积由滴数传感器自动给出)。
5.再将洁净的pH传感器插入烧杯中的氢氧化钠溶液中,并连接好数据采集器和电脑。
6.开始滴定并收集数据。
7.完成滴定后,处置反应中的混合物。用蒸馏水冲洗pH传感器,清洗仪器。
8.计算待测氢氧化钠溶液的浓度。
9.利用软件处理得出酸碱滴定曲线并加以分析。
六、交流讨论
1.观察滴定曲线,它有什么特点?如果向酸溶液中匀速滴入碱,滴定曲线应该是什么形状?
2.如果以指示剂变色时作为滴定终点,酚酞曲无色变为浅红色是pH=8,甲基橙由黄色变为橙色时pH=4.4,它们变色时 pH都不为7,即不是恰好中和,但是它们作为指示剂进行酸碱中和滴定时引起的误差并不大,请你结合滴定曲线予以说明。
3.若上述实验的指示剂改用甲基橙,滴定结果有何不同?为什么?
七、利用手持技术进行酸碱滴定实验的优势
通过pH传感器和滴数传感器实验检测滴定过程中溶液的pH,并由计算机显示数据和曲线,即可直观地反映出中和反应过程中pH的变化情况。
1、盐酸与氢氧化钠中和反应pH的变化
强酸与强碱的反应是一类最简单的中和反应,以盐酸与氢氧化钠反应为例,中和过程中的pH随标准液盐酸的体积变化如图所示。通过这条曲线可以帮助学生理解许多难点问题:(1)认识滴定过程的“突跃”是客观存在的;(2)通过数据曲可以发现,化学计量点附近的pH变化显著,尽管滴定终点与反应计量点并不完全一致,但引起的实验误差并不大,这正是酸碱中和滴定这一分析方法的科学 性和准确性得以保证的原因所在。
另外,数据采集器支持多个传感器同时工作,如果同时检测溶液的温度变化和pH变化则可以得到温度变化曲线,pH变化曲线反应过程中的能量转换以及pH变化情况得得到体现。
2.利用pH变化曲线进行数学建模
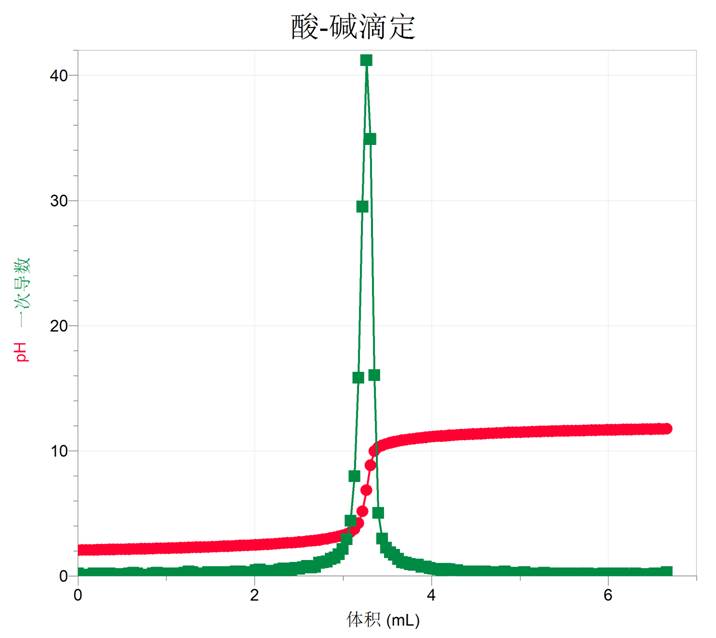
在微积分引入中学数学后,大大拓展了学生对数学问题的理解与认识,利用pH变化曲线进行微分变换,则可成为一个很好的构建化学问题教学建模的案例。与传感器配套的采集与处理软件一般都提供了利用函数进行数据分析和处理的功能,可以直接对检测的数据进行微分或积分计算,然后对函数曲线进行分析,省去了复杂的计算过程,却突出了其中的数学思想。
如果对滴定曲线求微分,得到一阶导数曲线,由导数曲线分析可得:(1)滴定过程pH数值减小,因此导数为负值;(2)在化学计量点之前,pH下降的速度加快,导数的绝对值增大;(3)在化学计量点之后,pH下降的速度减慢,层数的绝对值减小;(4)导数达到的极值点,便是化学计量点,对于突跃不太明显的反应,也可以用这各方法确定化学计量点。
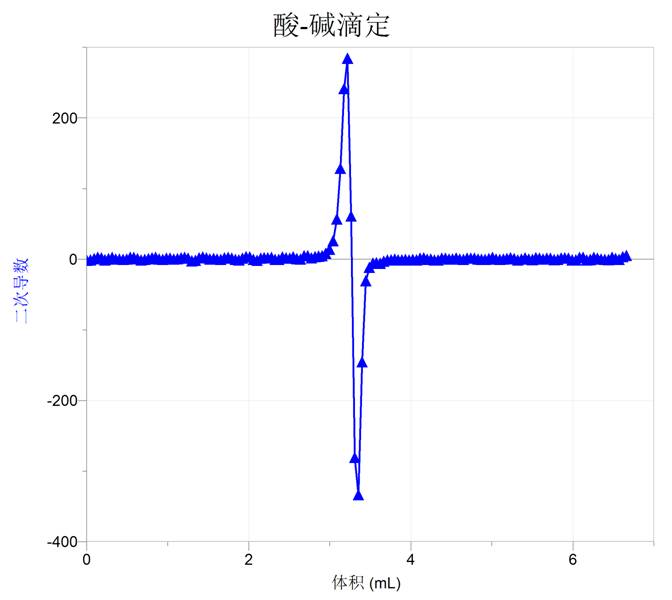
对一阶导数再次求微分,可得到二阶导数曲线,同样可以进行上述分析,这些都是微积分教学中的常规问题。利用传感器以及相关软件使得我们对变化的记录以及原理的提示更加简便,也为化学问题数学模型的整合提供了便利的条件。
利用传感器检测中和反应过程中pH的变化,经数据采集器和计算机的处理可以直接转化为曲线呈现,大大简化了绘制中和反应曲线的实验,使学生能够更加直观地认识这一过程pH的变化趋势,建议可作为新课程“反应反应原理”和“实验化学”相关内容的替代实验。